Онкология, рак — это страшные слова. Еще совсем недавно они означали верную мучительную смерть. К счастью, медики, биологи и фармацевты трудились, не покладая рук, и в наши дни онкологический диагноз — еще не приговор. Если своевременно принять меры, от рака можно излечиться и вернуться к полноценной жизни, тому есть огромное количество примеров. Но отработанные методы лечения, как оперативное вмешательство, химео- и радиотерапия, хоть и эффективны, но все еще далеки от совершенства. Главным образом потому, что сами по себе очень тяжелы для больного, имеют массу побочных эффектов и зачастую пугают пациента и его близких едва ли не больше самой болезни.
Процедуры, призванные уничтожить раковые клетки, что называется, «бьют по площадям», причиняя вред и здоровым тканям. Не столь фатальный, как раковая опухоль, но весьма ощутимый. Пациент чувствует себя отвратительно, его мучает тошнота, у него выпадают все волосы. Излечившемуся от основной болезни организму еще предстоит преодолевать последствия побочных эффектов терапии.

Как следствие, с лечением онкологии часто тянут до последнего, надеясь на чудо. Человек знает о своем диагнозе, но убеждает себя, что это ошибка, лечится травами, медитациями, в общем, всем чем угодно, лишь бы не обращаться в онкологическую клинику. Порой это заканчивается трагически. Момент оказывается упущен, и врачи бессильны, а ведь явись больной несколькими месяцами раньше, и его спасли бы почти наверняка. Поэтому ученые всего мира ищут новые, лучшие методы лечения. Отрадно сознавать, что не так мало в этой области было сделано в Украине.
Со своими исследованиями, которые ведутся в Институте молекулярной биологии и генетики Национальной академии наук Украины (г. Киев), нас познакомил старший научный сотрудник отдела биомедицинской химии института Максим Александрович Чеканов. Цель его научной работы заключается в том, чтобы создавать лечебные препараты селективного воздействия, умеющий выбирать себе мишень, уничтожая раковую опухоль и не причиняя вреда здоровым клеткам. В данном случае «мишень» — это не только образное выражение, но и научный термин.
«Развитие неинфекционных заболеваний связано с нарушением функционирования того или иного фермента (мишени), — объясняет ученый. — Если как следует изучить функцию и пространственное строение мишени, можно подобрать молекулу, которая свяжется именно с ней и будет регулировать ее активность». Искомая молекула называется лиганд, и она может служить лекарственным препаратом. Приоритетным направлением для Максима Александровича является поиск лигандов для ферментов, которые называются протеинкиназами.
Протеинкиназы — очень большая группа ферментов. Только в человеческом организме их известно более 500 видов. Их функция — модифицировать белки путем так называемого фосфорилирования — переноса остатков фосфорной кислоты, которые отщепляются от аденозинтрифосфата( АТФ). Это меняет свойства белков. Таким образом может изменяться метаболизм и передача сигналов в клетке, регулироваться ее деление и рост. Именно с неправильной «настройкой» протеинкиназы, ее слишком интенсивной работой связывают бурный неконтролируемый рост раковых опухолей.
Наверное, стоит сказать несколько слов о природе онкологических заболеваний вообще. Они довольно разнообразны и связаны с накоплением в клетках различных мутаций. В принципе в организме предусмотрен механизм, препятствующий сохранению и накоплению мутаций, — так называемый апоптоз, запрограммированная гибель клеток с поврежденной ДНК. Но иногда этот механизм оказывается испорченным, «неправильная» клетка сохраняется, размножается, у кого-то из ее потомков появляются новые мутации, которые, в свою очередь, передаются потомкам.
В конце концов возникают раковые клетки, которые называют «клетками с асоциальным поведением». Им нет никакого дела до интересов всего организма и до того, что их предки выполняли в этом организме определенные функции. Они стремятся лишь бесконтрольно размножаться и размножаются, нарушая равновесие, естественно, до момента гибели всего организма. Клетки опухоли гибнут вместе с ним, но они не умеют это прогнозировать.
В числе прочего протеинкиназы отвечают за регуляцию апоптоза. Их слишком бурная деятельность создает условия, препятствующие запрограммированной гибели клеток-мутантов. Вещество, подавляющее активность конкретной протеинкиназы (ингибитор), может стать отличным селективным средством борьбы с онкологическими заболеваниями.
Ряд такого рода препаратов уже применяется. Это Иматиниб, созданный в 1990 г. интернациональной группой ученых, в состав которой входили британцы, американцы и итальянцы, а также Гефитиниб, синтезированный в начале нулевых в Японии. Но этого мало. Люди нуждаются в большом количестве разнообразных противораковых препаратов селективного воздействия.
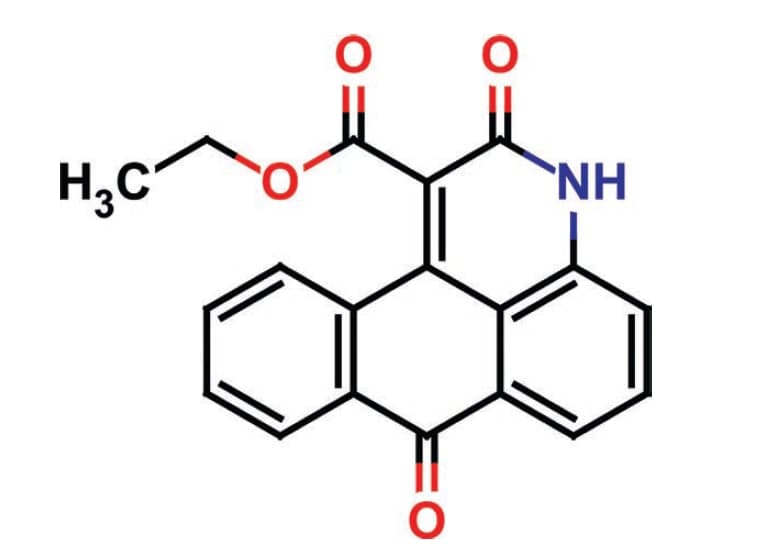
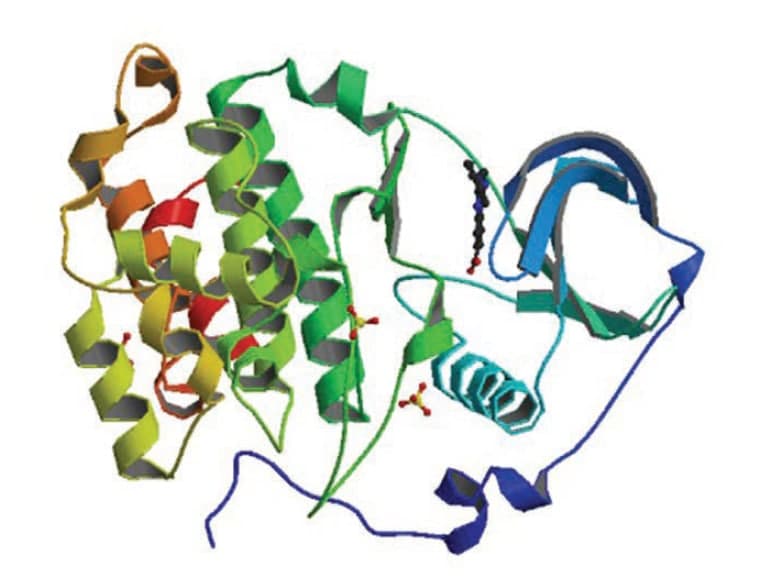
Молекулы ферментов — очень сложные образования, включающие в себя сотни атомов. «Прежде всего нужно установить трехмерную структуру протеинкиназы, — рассказывает Чеканов. — Для этого выращивают кристалл фермента. Потом с помощью рентгеноструктурного анализа определяют расположение атомов в молекуле киназы и строят ее пространственную модель. Если же данный вид киназы уже был выделен и охарактеризован другими исследователями, ее структуру можно найти на специальных интернетресурсах, таких как RCSBDataBank, и загрузить оттуда».
Наибольший интерес представляет фрагмент, связывающий АТФ, ведь задача исследователя состоит в том, чтобы получить молекулу, которая будет подходить к этому участку, «как ключ к замку», и сможет воспрепятствовать связыванию. Таким образом нежелательную активность протеинкиназы можно будет заблокировать.
Важной частью исследования является создание электронной базы данных, в которую будут входить тысячи молекул, как реально существующих, так и смоделированных виртуально. Последние могут быть синтезированы и получить физическое воплощение, если потребуется. Эти вещества должны отвечать ряду требований, необходимых для лекарственных препаратов: легко растворяться в воде, иметь молекулярную массу не больше 500 и т. д.
Далее идет отбор подходящих кандидатов в лиганды на уровне виртуальных моделей. Для этого используются современные математические алгоритмы, заложенные в программных пакетах для компьютерного моделирования: DOCK, AutoDock, MOE, FlexX, ICMPro и др. На выходе получается несколько сот потенциально подходящих молекул.
Следующий этап проходит уже в химической лаборатории с синтезированными веществами. Здесь проверяют, как активность ингибитора зависит от его химической структуры, намечают способы сделать препарат более эффективным. Синтезируют новые соединения и проверяют уже их поведение, строят новые модели.
В конце концов отбирается несколько ингибиторов, показавших себя наиболее активными. Их передают биологам, для тестирования непосредственно на раковых клетках.
«На первый взгляд все кажется довольно простым, — говорит исследователь. — Но на практике мы сталкиваемся с серьезными трудностями. Прежде всего 3D-структуру фермента нужно определить чрезвычайно точно, и это нелегко, так как не всегда удается вырастить кристалл фермента нужного качества. В отношении многих киназ этого так и не удалось до сих пор добиться. К тому же некоторые протеинкиназы очень близки между собой по строению. Их нужно изучать очень тщательно, чтобы отличить друг от друга. Именно используя эти незначительные, казалось бы, отличия, можно создавать селективные ингибиторы. Также важно учитывать, что ингибиторы должны быть высокоактивными, но все же не настолько, чтобы связать фермент необратимо и навсегда расстроить механизм работы клетки. Ну и синтез новых веществ является трудоемким и дорогостоящим процессом. Для решения всех этих проблем нами был разработан новый метод и система высокопродуктивного комбинаторного синтеза малых органических молекул».
В заключение нашей встречи мы задали исследователю несколько вопросов о внедрении результатов его работы в медицинскую практику.
— Максим, скажите, Ваши научные разработки уже где-то применяются?
— Да, нам удалось одним из первых в мире разработать и опубликовать высокоактивный и одновременно селективный ингибитор ASK-1 протеинкиназы, которая является важным звеном в развитии различных тяжелых заболеваний, в том числе рака, болезни Альцгеймера и сахарного диабета. Ми назвали это вещество NQDI-1. В названии использовали аббревиатуру названия химического класса вещества, использовавшегося в исследованиях. Этот ингибитор использовали в своих биомедицинских научных исследованиях около 10 групп ученых биологов и медиков по всему миру — США, Великобритания, Южная Корея, Китай, Германия и другие страны.
Наши зарубежные коллеги показали, что ингибитор NQDI-1 успешно замедляет развитие остеоартроза, защищает клетки головного мозга при перинатальном поражении, защищает почки от ишемических повреждений, обладает общими нейропротекторными свойствами, может использоваться как цитопротектор при лечение силикоза, а также резко подавляет рост клеток рака поджелудочной железы.
— Можно сказать, что данный ингибитор NQDI-1 — это новое лекарство от целого ряда серьезных заболеваний, включая рак?
— NQDI-1 успешно используется в научных исследованиях по разработке современных лекарств нового поколения против рака, воспалительных и аутоимунных заболеваний, но называть это химическое соединение лекарством пока преждевременно. Часто бывает так, что вещество, которое изначально использовалось в разработке лекарства, претерпевает ряд изменений химической структуры для улучшения его биологических свойств, например увеличения растворимости, уменьшения токсичности и т. д.Поэтому NQDI-1 — это удачный предшественник новых лекарственных препаратов, которые еще предстоит разработать на его основе.
— Вы можете разработать новые лекарства на основе NQDI-1 или других ингибиторов ASK-1?
— Дело в том, что разработка одного нового фармацевтического препарата — это очень долгая и дорогостоящая процедура. Стоимость выведения на рынок одного препарата обходится в 1,5 миллиарда долларов и около 10–15 лет исследований. Такие инвестиции могут позволить себе только крупные фармацевтические компании. Над разработкой новых препаратов работают не только химики и фармацевты, но также биологи и медики, которые проводят клинические и доклинические испытания. Наши исследования — это только первая ступень в разработке новых лекарств. Мы как ученые — медицинские химики разрабатываем новые молекулы — ингибиторы протеинкиназ, публикуем результаты в научных журналах, и наши разработки могут использовать ученые по всему миру для своих биомедицинских исследований, в том числе и фармацевтические компании для разработки новых лекарств.
— Проявляют ли зарубежные фармацевтические компании интерес к Вашим исследованиям?
— Фармацевтические гиганты постоянно ищут что-то новое, что они могут использовать для разработки новых лекарств. Для того чтобы коммерциализировать инновационный опыт, накопленный в результате исследований в сфере дизайна биоактивых молекул, мною были основаны научные стартапы в Украине и США — лаборатория УкрХимАнализ и AZEPINELLC. Эти компании разрабатывают и синтезируют новые химические билдингблоки, фармацевтические интермедиаты и биоактивные соединения, которые используются для создания новых лекарств международными фармацевтическими гигантами, научно-исследовательскими лабораториями зарубежных университетов и госпиталей. В основном для борьбы с раком, сахарным диабетом и болезнью Альцгеймера. Мы сотрудничаем с такими всемирно известными фармкомпаниями, как Merck, Bayer, Novartis, а также с Колумбийским университетом (США), японскими и южнокорейскими hitech-компаниями. Наша украинская химическая лаборатория получила награду и звание «Лидер года 2017» от Национального бизнес-рейтинга, что подтверждает нашу ценность также и для рынка Украины.
Сейчас для американского фармацевтического рынка мы готовим к запуску еще один новый проект — online-маркетплейс. Это будет что-то наподобии Amazon, но только для ученых — медицинских химиков. Он позволит американским исследователям легко находить зарубежных партнеров, имеющих опыт в определенных областях медицинской химии, и размещать у них заказы на разработку и синтез фармацевтических интермедиатов и билдинг-блоков. Это существенно ускорит и удешевит разработку новых лекарств американскими учеными-фармацевтами.
Статья была опубликована в июньском номере журнала "Наука и техника" за 2019 год